がん化 老化 生活習慣病を仕切る p53
<老化は発がんを予防する> 細胞が老化するということは 不可逆的に増殖を停止することで この反応を起こす直接的なメカニズムは 細胞がDNA傷害を受けた際に その傷害から守るための反応の DNA 損傷応答(DNA damage response) であることを説明しましたDNA損傷は 発がんの大きな原因のひとつですので その傷害から 細胞を守る反応である細胞老化には 細胞ががん化して 無制限に増殖することを抑制する という 発がん予防的な機能があります
DNAが傷ついた細胞は 自らが持つ修復機能を用いて DNAの傷害の修復を試みますが 傷害の程度が 修復能力の限界を越えている場合は DNA傷害が蓄積して細胞ががん化しないよう 別の手段を講じます そのひとつが 自らを死に至らしめる手段で こうした細胞の死に方を アポトーシスと呼びます アポトーシスについては 既に解説しましたので 興味がある方は復習されてください そして もうひとつの手段が DNA 損傷応答(DDR)により 細胞周期を停止させ 不可逆的に増殖できないようにする つまり 老化細胞になることです <p53・がん抑制遺伝子> さて 細胞の がん化 と 老化 の 両方に関わる因子として注目されるのが p53というがん抑制遺伝子です p53は DNAに傷が入ったことを察知し *傷が軽度な場合は 細胞周期の回転を止め修復機構を活性化させ *傷が重度で修復が不可能な場合は アポトーシスを起こさせます
発がんを抑制するp53遺伝子の 翻訳タンパクのp53タンパクは 遺伝子発現を制御する転写因子です p53タンパクが 発現制御に関わる標的遺伝子は多岐にわたり 100個以上のタンパクの発現を誘導します そのなかには *細胞周期関連タンパク (p21など) *アポトーシス関連タンパク (Bax Noxa Pumaなど) *DNA修復関連酵素 などが含まれていて それらのタンパクを 発現させ機能させることで p53は自らの作用を発揮します
p53タンパクは 細胞内では 通常はユビキチン化という処理を受け タンパク質を分解するプロテアソーム系で すぐに分解されますが がん遺伝子の活性化やDNA損傷が起こると ATMキナーゼによりリン酸化され ユビキチン化を受けなくなり 上述したような作用を発揮して 発がん阻止に働きます
多くのがんでは p53遺伝子は変異を受けて p53タンパクが機能しないので 発がんが起こってしまいます
<p53は老化を促進する> 一方 p53は個体老化にも関連します 個体の老化において p53依存性の細胞老化シグナルが重要で DNA 損傷応答におけるp53 活性化によって p53 依存性細胞老化シグナルが活性化し 細胞老化が誘導されます また p53遺伝子を不活化すると 長寿になることが明らかになり ミトコンドリアでの酸素消費が低下して 酸化ストレスが減ることが (ミトコンドリアでのATP産生効率は変化していない) 老化の抑制を誘導すると考えられています
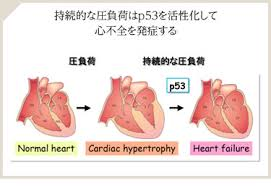
<p53は生活習慣病を誘導する> p53シグナルの活性化が 心臓病や肥満・糖尿病の病態に関与することも 明らかにされています
心不全の患者さんでは 心筋内でp53発現が増強することで 老化反応により血管新生反応が減弱し 心筋に充分な血流が供給されず 心筋虚血が生じて心不全が発症・進展します
また 肥満時には 内臓脂肪組織でのp53シグナル活性化を認めますが p53シグナルを介して誘導された細胞老化により 内臓脂肪内の慢性炎症と 全身のインスリン抵抗性が生じる可能性が考えられ
p53 をノックアウトした糖尿病モデルマウスでは *内臓脂肪における細胞老化 *悪玉アディポカイン産生やマクロファージの浸潤 が抑制され 全身のインスリン抵抗性や耐糖能異常も 改善することが報告されています このように p53は がん抑制遺伝子として発がんを制御しますが その過剰な活性化は 細胞老化を促進することにより さまざまな加齢にともなう疾患の発症進展に 関わる可能性があります
しかし そうした疾患の治療を目的に p53の活性を極端に抑制すると 発がんを招いてしまいます p53と上手に付き合う方法を 検索していくことが大切なようです
高橋医院
























